|
|||||||||
 |
|||||||||
|
|
|||||||||
 |
|||||||
|
ABSORPTION MOLÉCULAIRE
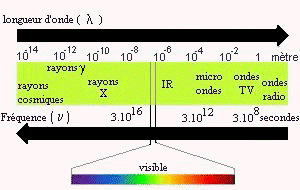
Ensemble continu des ondes électromagnétiques connues, classées dans l'ordre de leurs longueurs d'ondes, de leurs fréquences, de leurs énergies.
Radiations électromagnétiques La lumière visible est constituée de radiations électromagnétiques auxquelles l'il humain est sensible. Ces ondes sont perçues comme étant colorées, tandis que la superposition de différentes longueurs d'ondes couvrant tout le domaine du spectre visible constitue une lumière blanche. Les ondes électromagnétiques sont généralement caractérisées par les grandeurs suivantes :
Ces grandeurs sont reliées par la relation suivante :
où c la célérité est la vitesse de la lumière (3.108 m.s-1). Unités Selon le domaine considéré, on utilise une unité différente pour la longueur d'onde par commodité. En IR En infrarouge, les longueurs d'onde sont exprimées en micromètre (µm) appelé aussi micron. 1 µm = 10-6 m = 10-4 cm Mais pour avoir une grandeur proportionnelle à la fréquence et donc également proportionnelle à l'énergie on utilise souvent le nombre d'onde (toujours exprimé en cm-1). Ainsi, à la longueur d'onde de 10µm du domaine infrarouge correspondent la fréquence 3.1013Hz, le nombre d'onde s =1000cm-1 et l'énergie 12kJ.mol-1. En UV / visible En UV, on utilise essentiellement le nanomètre (nm). 1 nm = 10-9 m
THÉORIE DE LA SPECTROPHOTOMÉTRIE L'absorption d'un photon correspondant au domaine de longueur d'onde de l'ultraviolet et du visible, provoque une augmentation de l'énergie de la
molécule de l'ordre de 400000 J.mol-1, conduisant à un changement de l'état électronique, vibrationnel et rotationnel de la molécule : h.n = (DE)électronique + (DE)vibrationnel + (DE)rotationnel Pour une transition électronique donnée, il existe de nombreuses possibilités différentes pour des transitions vibrationnelles et rotationnelles, il y aura donc absorption dans un assez large domaine de longueur d'onde et si la résolution de l'appareil n'est pas suffisante on verra, comme c'est souvent le cas, de larges bandes d'absorption ; quelquefois dans des conditions favorables on pourra résoudre la structure fine de vibration. Lorsque le lumière arrive sur un milieu homogène, une partie de cette lumière incidente est réfléchie, une partie est absorbée par le milieu et le reste est transmis. Intensité et flux L'intensité est un mot qui désigne diverses grandeurs qui n'ont pas la même dimension. En photométrie, l'intensité est un flux d'énergie par unité d'angle solide délivré par une source ponctuelle. Or dans la pratique, une source n'est jamais ponctuelle mais rayonne. L'angle solide est considéré identique pour la référence et la mesure, on assimile le flux lumineux à l'intensité. Si Io est l'intensité de la lumière incidente, Ir celle de la lumière réfléchie, Ia celle de la lumière absorbée, It celle de la lumière transmise, on peut écrire la relation suivante: Io = Ir + Ia + It Pierre BOUGUER (1698-1758) en 1729, Jean Henri (Johann Heinrich) LAMBERT (1728-1777) en 1760 et August BEER (1825-1863) ont particulièrement étudié les relations qui existent entre l'intensité incidente et l'intensité transmise. La spectrophotométrie et la colorimétrie sont fondées sur la loi de Beer - Lambert . Loi de Bouguer - Lambert Lorsqu'une lumière monochromatique d'intensité I0 traverse un milieu homogène, l'intensité de la lumière émergente I décroît exponentiellement lorsque l'épaisseur l du milieu absorbant augmente.
Loi de Beer En analyse quantitative, on étudie principalement des solutions. Dans ce cas, la loi de Beer fait intervenir les concentrations. Elle s'exprime sous une forme tout à fait semblable à la précédente : où e est un coefficient d'absorption caractéristique de la substance appelé coefficient d'extinction, l est l'épaisseur de la cuve et c la concentration de la solution. Finalement la relation fondamentale utilisée en spectrophotométrie est présentée sous la forme: Équation 2 : Loi de Beer - Lambert L'épaisseur de la cuve est exprimée en centimètres, le coefficient d'extinction dépend de la manière dont est exprimée la concentration de la solution. Si la concentration est exprimée en grammes par litre, e est appelé coefficient d'extinction spécifique. Si la concentration est exprimée en moles par litre, e est appelé coefficient d'extinction molaire . Termes à connaître Certains termes sont d'usage courant en spectrophotométrie. La densité optique D.O. ou D, encore appelée extinction, est le logarithme du rapport de l'intensité incidente à l'intensité transmise. La transmission T est définie comme le rapport de l'intensité transmise à l'intensité incidente. Validité et application de la loi de Beer - Lambert En général, cette loi est valable dans un large domaine de concentration si la structure de l'ion, de la molécule ou du composé formé n'est pas modifiée par une variation de concentration. En général, les écarts à la loi de Beer - Lambert résultent soit de l'ionisation, soit de la dissociation, soit de l'association de solutés puisque la nature de l'espèce présente varie en fonction de la concentration. On observe également des écarts à la loi de Beer - Lambert lorsque le soluté forme des complexes, la composition de ces derniers dépendant de la concentration, ou lorsqu'il s'agit de solutions fluorescentes ou de suspensions. Enfin, pour que la loi de Beer - Lambert soit vérifiée, il faut utiliser une lumière monochromatique.
|
|||||||