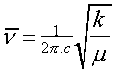|
||||||||||||
 |
||||||||||||
|
|
||||||||||||
 |
||||
|
Introduction La spectrométrie infrarouge (IR) s'utilise principalement pour l'analyse qualitative d'une molécule. Elle permet de mettre en évidence la présence d'une liaison
particulière. La région du spectre IR s'étend de 0,75 à 300 mm, mais la majorité des applications se situe entre 2,5 et 15 mm soit en nombre d'onde de 4000 cm-1 à 670 cm-1. Équation 3 : relation entre longueur d'onde et nombre d'onde Le nombre d'onde est l'unité encore le plus couramment utilisée en spectrométrie IR. Il a l'avantage d'être directement proportionnel à la fréquence (donc à l'énergie) du rayonnement absorbé. L'absorption du rayonnement IR par les composés organiques correspond à deux types principaux de vibrations atomiques :
En effet, lorsque la molécule absorbe de l'énergie sous la forme d'un rayonnement IR, l'amplitude de ces vibrations est augmentée, le retour à l'état normal libère de la chaleur. Plusieurs modes de vibrations sont possibles pour un groupe d'atomes donnés. A chacun correspond une fréquence caractéristique, mais seuls les mouvements qui entraînent une variation du moment dipolaire électrique, donnent lieu à des bandes d'absorption IR. Ces modes fondamentaux sont responsables des principales bandes d'absorption trouvées dans les spectres. D'autres bandes, d'intensité moindre, peuvent se produire à des fréquences qui sont soit des multiples des fréquences fondamentales, soit égales à leur somme ou leur différence: elles correspondent à des harmoniques ou à des bandes de combinaisons. Le spectre résultant est donc souvent complexe. Vibration de valence et vibration de déformation On appelle vibration de valence ou élongation, les vibrations dans l'axe du dipôle. Ces vibrations, dès qu'elles intéressent trois atomes peuvent être symétriques ou asymétriques : c'est le cas de >CH2 , -CO2 . Dans ces conditions on observe toujours deux bandes: celle qui présente le plus grand nombre d'ondes et donc qui nécessite l'absorption de l'énergie la plus forte est toujours la vibration asymétrique. Elles se trouvent dans la zone du spectre IR de 4000 cm-1 à 1000 cm-1. Les vibrations de déformations plus faibles que celles de valence sont nombreuses et beaucoup plus sensibles à l'environnement car elles ont besoin pour se produire d'un volume plus important et risquent donc d'être entravées par la présence d'atomes voisins. Elles peuvent se produire dans le plan ou hors du plan. Ces vibrations constituent la région du spectre dite “empreinte digitale“ (1600 à 600 cm-1). Elles sont souvent difficiles à attribuer mais permettent par exemple de déterminer la présence d'un substituant en position ortho, méta ou para d'un aromatique. Fréquence fondamentale En première approximation, la formule Équation 4: Fréquence fondamentale en IR permet de prédire la zone d'absorption correspondant à la vibration de valence d'une espèce diatomique.
Par exemple, si un atome est le carbone, m1 est égale à: c la vitesse de la lumière, = 1/l est la fréquence exprimée en nombre d'ondes. La fréquence d'élongation dépend de deux facteurs:
Éléments constituant un spectrophotomètre infrarouge Il existe 2 sortes de spectromètre IR: le spectromètre à balayage et le spectromètre à transformée de Fourier. Un spectromètre IR à balayage est composé des éléments suivants :
|
||||